微生物の命の力によるものづくり
准教授 原 清敬 (Assoc. Prof. Kiyotaka Hara)環境工学研究室
私は、これまでに微生物の研究、特に微生物の命の力をものづくりに役立てる研究を行ってきました。本コラムでは、これらの研究の一端をご紹介できればと思います。
微生物との出合い
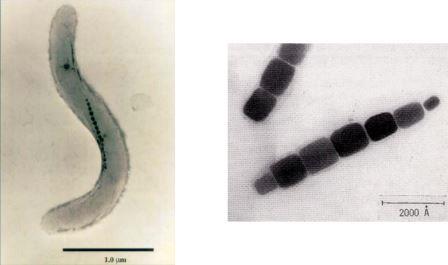
微生物との出会いは、小学校2年生の時にさかのぼります。校庭のタイヤに溜まった水の中に何やら動くものがあり、その正体を理科室の顕微鏡で覗いたときに始まります。ミジンコとの出会いです。微生物の魅力に引き込まれ、親にせがんで小さな顕微鏡を買ってもらいました。その顕微鏡は、いまでもこのコラムを執筆しているデスクの片隅に置いてあります。微生物のどこに魅力を感じたかは定かではないのですが、その小さな体に生きるための機能がぎっしりと詰まっているところに、生命の神秘のようなものを感じたように記憶しています。その後、獣医になりたいと思った時期もありましたが、微生物が我々の生活のいたるところで役に立っているということを知るにつけ、微生物の応用研究を志して、当時生命理工学部という新しい学部ができた東京工業大学に入学しました。東工大の生命理工学部では、2年生の時の学科所属の際に、基礎研究を行う理学系と応用研究を行う工学系の2つに大きく道が分かれます。入学時の動機からすれば、当然工学系に進むつもりでしたが、1年生の時に生命の仕組みを解き明かす理学的な研究にも興味を持ってしまいました。相当に悩んだ末、当時微生物の研究をしていらっしゃった理学系の大島泰郎先生と工学系の海野肇先生に相談に伺いました。その中で、大島先生に「今どうしても決められないのであれば、応用研究から基礎研究に移るのは難しいが、逆なら頑張れば可能」という助言をいただいたことが決定打となり、理学系の学科に進むことを決心しました。そして、学部4年時の研究室配属では、福森義宏先生の主宰する微生物学の研究室を選びました。そこでは、細胞内に磁性粒子をもつ磁性細菌の研究を行いました(図1)。磁性細菌は、嫌気的な海底方向を知るために、磁性粒子を持っていると考えられていましたが、当時その走磁性自体を測定した研究はなく、テーマは磁性細菌の走磁性の定量に決まりました。ヘルムホルツコイルを作製し、磁性細菌を詰めたキャピラリー(細いガラス管)をセットし、地球磁場の影響を排除するため、ミューメタルという特殊な金属でできた箱の中に入れ、磁場をいろいろと変えながら、キャピラリーの中の磁性細菌の分布を調べるために、細かく裁断したキャピラリーの中の磁性細菌の数をひたすら数えました。その結果、磁性細菌は走磁性だけでなく重力も感知しているということが分かり、海底方向を知るために磁性粒子をもつという定説に疑問を呈しましたが、論文になるほどの説得力のあるデータはとれず、4年生の1年間を終えました。しかし、最初に所属した研究室は、初めて本物の研究に触れる場であり、20年近くを経た今でも自分の考え方や姿勢の礎になっていることをたびたび感じます。
微生物の命の力を感じる
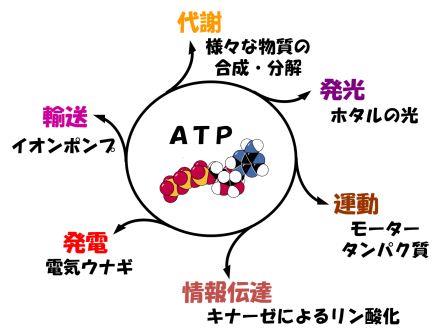
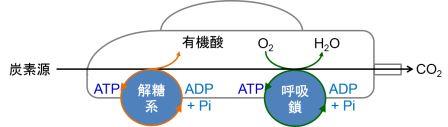
福森先生が金沢大学に移られることになり、修士からは吉田賢右先生の主宰する生化学の研究室に移りました。吉田研究室では、ATPの関わる酵素の研究が行われていました。すべての生物は、ATPに貯められたエネルギーを使って生きています。つまり、細胞の経済では、ATPは使い勝手の良い小銭なのです。そのため、ATPはエネルギー紙幣ではなく、エネルギー通貨と呼ばれています。実際に、ATPは、様々な物質の合成、分解、輸送、運動、情報伝達のほか、ホタルの発光や電気ウナギの発電など、細胞内のあらゆる反応にエネルギーを供給しています(図2)。植物や光合成細菌などは、光合成によってATPを作ることができますが、光合成ができない多くの従属栄養生物の細胞内では、解糖系と呼吸鎖電子伝達系の2種類のシステムによってATPを作っています(正確には、様々な生命活動にエネルギーを与えるためATPが分解され、生じたADPとリン酸Piから再度ATPを再生する)。そのため、これらの生物は、解糖系という前輪と呼吸鎖という後輪で駆動される四輪駆動車に例えることができます(参考文献1)(図3)。当時の吉田研究室では、好熱菌という微生物の細胞内でATPを作っているATP合成酵素の研究が進められており、ATP合成酵素が電気モーターのように分子内で回転を引き起こすモータータンパク質であることを証明する研究がなされ、調度Nature誌に論文が掲載されたばかりのタイミングでした。なぜ、好熱菌かというと、高温に住む好熱菌の酵素は、熱に安定であり、実験中もちょっとやそっとでは、壊れないからです。修士のテーマは、このATP合成酵素の分子内回転メカニズムの解明でした。ATP合成酵素の回転軸に相当する部分に蛍光ラベルしたアクチン繊維を結合させ、顕微鏡下でぶんぶん回るアクチン繊維をひたすら探しました。この回転はATPの合成とは逆向きの反応で、ATPのエネルギーを使って分子内の回転軸に相当する部分を回しているのです。まさに、微生物の命の力を感じた瞬間でした。当時、回転トルク(仕事量)の発生部位と考えられていた電荷をもつアミノ酸が集まる保存性の高い領域のアミノ酸を、ことごとくアラニンという電荷を持たないアミノ酸に置換しました。その結果、いくら電荷をなくしても、ATP合成酵素はへっちゃらで、何食わぬ顔で相変わらずぶんぶんと回っており、回転トルクを計測しても、野生型と全く変わりません。また、定説に裏切られました。そのため、私の記念すべき第一報は、この領域の電荷が回転に関与しないという、ネガティブな内容の論文になりました。その後、博士課程に進むことを決めたので、別の回転トルク発生部位を探すという方向性もありましたが、私は、この電荷領域が何をしているのか、どうしても知りたくて、電荷を打ち消した変異体の性質を生化学的にいろいろと調べました。その結果、本領域は、ATPの合成や分解を制御している、活性スイッチ部位であることを突き止めました。これが人生で2報目の論文になりました。このような好熱菌のATP合成酵素に関する一連の研究で、博士(理学)の学位を取得しました。
微生物の命の力を借りる
その後、ポスドクとして都立臨床研の原田慶恵先生の研究室にお世話になり、バクテリオファージの分子内回転によるDNA詰込み過程の可視化の研究を行っていましたが、「微生物の応用研究がしたい。」というかつての思いが段々と強くなり、協和発酵工業株式会社(現在の協和発酵バイオ株式会社および協和発酵キリン株式会社)に移籍しました。発酵とは、微生物の力を借りて人に役立つ物質を作る分野です。発酵食品は、原料を微生物に食べさせて微生物の細胞内で起こる代謝(物質の連続的な変換)により、原料に含まれない様々な物質を含みます。味噌、醤油、酒、酢、漬物、納豆、チーズ、ヨーグルト、ナタデココ、クズモチなど様々な発酵食品が、微生物の力を使って生産されています。また、麹(コウジ)菌、酵母、乳酸菌、枯草菌などの微生物がよく用いられ、2種類以上の微生物を同時に用いる場合もあります。一方、これらの発酵食品が様々な成分の混合物であるのに対し、特定の化合物の生産を目的とする発酵もあります。医薬品、ビタミン、機能性食品素材、食品添加物、化粧品素材、補助飼料、植物活性化物質、油脂、プラスチック原料、有機酸、アルコールなど、様々な化合物が発酵生産されています。これらの特定化合物の生産を目的とする発酵では、発酵食品とは異なり、基本的には1種類の微生物(前述の微生物だけでなく、放線菌やコリネ細菌、大腸菌等)が用いられ、発酵終了後には目的化合物を精製し、純度を100%に近づける工程が加わります。協和発酵工業でも、上記のような様々な化合物の生産研究が行われていました。私は、森英郎主任研究員の研究室で、大腸菌の個々の遺伝子の評価と大規模な遺伝子破壊により有用物質生産宿主の創製を目指すミニ(マム)ゲノムファクトリーの研究を行いました。具体的には、大腸菌の解糖系ATP合成活性を強めることを目指し、ハイスループット(迅速に多検体を一度に処理すること)な解糖系ATP合成活性の測定法を確立しました。次に、この方法を用いて奈良先端大学・森浩禎先生らが作製された約4,000株の大腸菌単一遺伝子破壊株のATP合成活性をひたすら測定し、ATP合成活性の高まった単一遺伝子破壊株を複数得ました。そして、これらの株を活用して、合成にATPのエネルギーを必要とし、抗酸化作用や解毒作用を有するトリペプチドであり、医薬品や機能性食品素材、植物活性化物質として需要が高まるグルタチオンの生産性を向上させました。
その後は、早稲田大学の木野邦器先生の主宰する研究室に移籍し、光のエネルギーを用いてATPを再生し、有用物質を持続的に生産するエネルギー循環的な微生物発酵生産サイクルの研究に取り組んだ後、前職の神戸大学では、バイオマスからバイオ燃料やバイオプラスチック原料、バイオファインケミカルを生産させるバイオリファイナリーの研究プロジェクトに参画しました。バイオリファイナリーとは、いずれ枯渇する化石資源に頼り石油から様々な化合物を生産している現代のオイルリファイナリー社会の転換を目的に、再生可能なバイオマスから様々な化合物を生産することを目指す分野です。本分野では、バイオエタノール等のバイオ燃料の生産研究が先行していますが、バイオリファイナリー社会を実現させるためには、バイオ燃料などの低価格だが市場の大きいものと、バイオファインケミカル(医薬品、化粧品、機能性食品素材、食品添加物、飼料添加物、植物活性化剤など)のように市場は小さいが高価であるものを共通のバイオマス原料から生産し、市場規模とコスト競争力を共に確保することが重要です(参考文献2)。神戸大学における私のテーマは、酵母を用いたバイオファインケミカルの生産でした。具体的には、前述のグルタチオンのほか、抗酸化作用を有し、養殖魚等の色揚げ剤や食品の天然着色料および機能性食品・補助飼料として用いられているアスタキサンチン、植物の光合成能力を高める植物活性化剤などとして用いられている5-アミノレブリン酸を、酵母でつくる研究も行ってきましたが、ここでは、遺伝子組換え技術を用いた酵母のグルタチオン生産研究について紹介します。
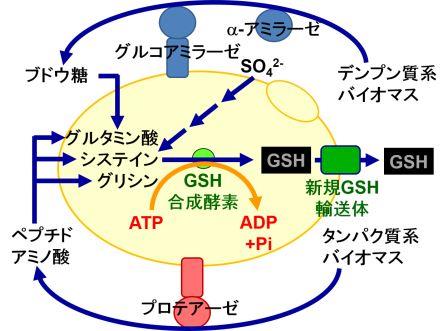
酵母の細胞表層または細胞外にバイオマス分解酵素を発現させることで、バイオマスから有用物質を生産可能な酵母の開発を行いました。例えば、酵母は米のデンプンを分解することができません。そこで、デンプン分解酵素であるアミラーゼの発現酵母を用い、低温処理した地元玄米からグルタチオンを直接発酵することができました(図4、図5)。また、インドネシアとの国際共同研究により、酵母にマンナン分解酵素を発現し、インドネシアに豊富に存在するマンナン系未利用バイオマスからグルタチオンを直接発酵しました。一方で、タンパク質分解酵素であるプロテアーゼの発現酵母を創製し、大豆粕やケラチンなどのタンパク質系バイオマスから基質となる3つのアミノ酸(グルタミン酸、システイン、グリシン)を直接供給する新たなグルタチオン生産系を構築しました(図5)。また、出芽酵母のグルタチオン合成系やアミノ酸代謝など、代謝系を強化することで、グルタチオンの生産性を高めました。しかし、細胞内でグルタチオンを生産させる限り、空間的な限界を免れません。そこで、ATPのエネルギーを用いてグルタチオンを細胞外へ運び出す輸送体を出芽酵母で新規に同定し、その発現量を増強することでグルタチオンを選択的に細胞外へ生産することができました(図5)。
おわりに
このように、これまでの私の研究は、微生物の命の力、ATPという生物共通のエネルギー物質に関する基礎・応用研究です。ここで、『命』という字をよく見てください。そう、『命』という字にはATPという文字が隠されています。AとPはあったけど、Tは見えないという方は、自分で命という字を書き、心を落ち着けてもう一度。そう、真ん中あたりの隙間・・・これは、私がこれまでにした発見の中で最も大きいものです。今後の研究人生では、この発見を超えるような発見・発明をしたいです。最後に、このコラムでは、研究内容だけでなく、どのような考え方で研究を行っているかを述べるということですので、研究に対するモットーを述べて終わりたいと思います。それは、「のらりキラリ」です。キラリするために、のらりする。くらりする前に、キラリするということです。ずっとのらりしているとくらりしてしまいます。そこが、難しいところです。あくまでキラリするために、のらりしているのであって、のらりくらりしたいわけではありません。そのバランスとタイミング、メリハリが肝要です。のらりするには、例えば散歩は最適です。私は、よく研究室から突然いなくなることがありますが、それはサボっているわけではなくって、散歩をしながら思索をしている大切な時間です。味気のないモニターの前に座って唸っていても、ちっともよいアイディアは浮かびません。せいぜい使えるサイトを見つけるくらいが関の山です。
私は、このコラムを執筆している2015年から、静岡県立大学で新たな研究をスタートするチャンスに巡り合えました。これまで、いろいろな場所で研究をしてきましたが、ここ県大は、のらりキラリするには格好の場所だと思います。地域に開かれた大学ということもあり、門もなく、ふらりとのらりできる最高の環境です。前職の神戸大学もそうでしたが、日本平に位置する県大付近は坂が多く、散歩をしていると、適度なアップダウンが脳と体を刺激します。今後も、のらりキラリと研究を進めていきたいと思います。
参考文献
- . ATP regulation in bioproduction. Microb Cell Fact 14, 198, 2015.
- . Development of bio-based fine chemical production through synthetic bioengineering. Microb Cell Fact 13, 173, 2014.
(以上)
>>次のコラム: -第29回- 「メダカ近縁種を用いて多様化した性決定の仕組みを解明」 明正 大純